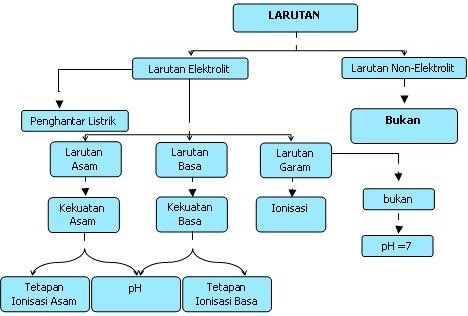
LARUTAN ELEKTROLIT DAN NONELEKTROLIT
PENGERTIAN LARUTAN ELEKTROLIT
Gambar di atas
merupakan hasil pengujian daya hantar listrik terhadap:
(a) Larutan non elektrolit
(b) Larutan elektrolit lemah
(c) Larutan elektrolit kuat
Larutan elektrolit adalah
larutan yang dapat menghantarkan arus listrik, memberikan gejala berupa
menyalanya lampu pada alat uji atau timbulnya gelembung gas dalam larutan.
Sedangkan larutan non elektrolit adalah larutan yang tidak dapat menghantarkan
arus listrik, sebabnya karena larutan tidak dapat menghasilkan ion-ion.
Contoh Larutan Elektrolit dan Non elektrolit

Jika dilihat dari
hasil pengujian larutan pada tabel di atas, kita bisa simpulkan bahwa larutan
yang dapat menghantarkan arus listrik, yaitu larutan amonia, larutan HCl,
larutan cuka, air aki, air laut, air kapur, dan larutan H2S. Adapun
larutan yang tidak menghantarkan arus listrik, yaitu larutan urea, larutan
alkohol dan larutan glukosa.
Sekarang, coba deh
perhatikan lagi data larutan yang bersifat elektrolit. Ternyata, ada larutan
elektrolit yang memberikan gejala berupa menyalanya lampu pada alat uji dan ada
pula yang tidak. Tetapi, semuanya menimbulkan gejala hantaran listrik berupa
adanya gelembung gas. Larutan elektrolit yang memberikan gejala berupa lampu
menyala dan membentuk gelembung gas disebut elektrolit
kuat. Contohnya yaitu HCl, air aki, air laut, dan air kapur.
Adapun elektrolit yang
tidak memberikan gejala lampu menyala tetapi menimbulkan gelembung gas
termasuk elektrolit lemah. Contohnya yaitu larutan amonia,
larutan cuka,dan larutan H2S. Lalu, kalian tahu nggak mengapa larutan
elektrolit dapat menghantarkan arus listrik, sedangkan larutan nonelektrolit
tidak?
Jadi, Larutan elektrolit
kuat terbentuk dari terlarutnya senyawa elektrolit kuat dalam pelarut air.
Senyawa elektrolit kuat dalam air dapat terurai sempurna membentuk ion positif
(kation) dan ion negatif (anion). Arus listrik merupakan arus elektron. Pada
saat dilewatkan ke dalam larutan elektrolit kuat, elektron tersebut dapat
dihantarkan melalui ion-ion dalam larutan, seperti dihantarkan oleh kabel.
Akibatnya, lampu pada alat uji elektrolit akan menyala.
Aki (akumulator) sebagai sumber arus listrik yang dapat diisi ulang adalah komponen yang penting dalam kendaraan bermotor. Sebagai sel elektrokimia, aki terdiri dari komponen elektroda dan larutan elektrolit. Larutan elektrolit yang terdapat dalam aki adalah larutan asam sulfat yang biasanya dikenal sebagai air aki accuzuur.
MEKANISME HANTARAN LISTRIK MELALUI LARUTAN
Menurut teori ionisasi Arrhenius, larutan elektrolit dapat menghantarkan listrik karena terdapat ion-ion yang bergerak bebas dalam larutan. Ion-ion tersebut yang berperan dalam menghantarkan arus listrik melalui larutan. Sebagai contoh, larutan NaCl merupakan larutan elektrolit. Zat terlarut NaCl di dalam pelarut air akan terdisosiasi (terurai) menjadi ion Na+ dan ion Cl−. Dalam eksperimen hantaran listrik larutan elektrolit dengan menggunakan sumber arus listrik searah, lampu, dan dua elektroda, ion-ion bermuatan positif akan bergerak ke arah elektroda yang terhubung ke kutub negatif (katoda) sedangkan ion-ion bermuatan negatif akan bergerak ke arah elektroda yang terhubung ke kutub positif (anoda).
Pada larutan non elektrolit, zat non elektrolit yang terlarut tidak dapat terurai menjadi ion-ion, sehingga tidak terdapat ion-ion bebas yang dapat menghantarkan arus listrik. Sebagai contoh, larutan gula sukrosa (C12H22O11) merupakan larutan non elektrolit. Zat terlarut sukrosa di dalam pelarut air tidak dapat terurai menjadi ion, sehingga tidak terdapat ion bebas yang dapat menghantarkan listrik.



Post a Comment